TA・RA
悪性胸膜中皮腫におけるミスラマイシンの抗腫瘍効果の解析
名前と所属

植田 源(Ueta Gen) 所 属 生物統合工学専攻 糖鎖生命工学研究室 (古川 清 教授)
学 歴 2004年 新居浜工業高等専門学校 生物応用化学科 卒業
2006年 長岡技術科学大学 生物機能工学専攻 卒業
2008年 長岡技術科学大学 生物機能工学専攻 修士課程 修了
研究内容
石綿(アスベスト)は優れた物性から、日本でも「奇跡の鉱物」として珍重され、様々な工業製品に使用されてきた。しかし、その生活環境における曝露が原因となり、悪性胸膜中皮種 (MPM) が引き起こされることが知られている。MPMは治療困難な腫瘍で、その有効な治療法は確立されていない。そこで、本研究では我々の研究から有効であろうと考えられる抗がん剤を選定し、その効果を評価した。
細胞ががん化すると糖鎖の構造が変化し、悪性度と相関することが知られている。そこでがん細胞の悪性度を抑えるため、糖鎖を合成する糖転移酵素の幾つかの発現を制御する転写因子Sp1に着目し、その発現を抑制するミスラマイシン (MIT) の腫瘍抑制効果を検討した。さらに、Sp1はMPMで発現の増大が報告されている血管内皮増殖因子(VEGF)やプログラム細胞死阻害因子(survivin)の発現も制御することが知られているため、複合的にMPMの悪性度を抑制することが期待された。
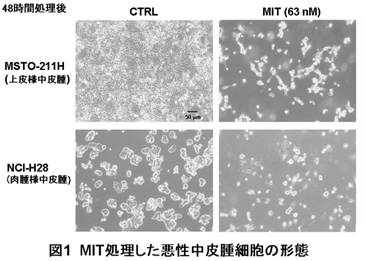
MIT処理により、ヒト悪性中皮腫由来の細胞の増殖は、形状の違いによらず濃度依存的に抑制された(図1)。また、63 nM MITで48時間処理した細胞ではSp1およびVEGFの発現量が減少し、悪性度に関与する高分岐N-型糖鎖と結合するL-PHAの反応性が減少した。同様に処理した細胞をヘキストで染色すると核の凝集が起こり、タネル染色も陽性となり、プログラム細胞死が起きていることが確認された。さらに、そのプログラム細胞死のシグナル経路の解析から、デス受容体依存的なものであることが判明した。
以上の結果から、MITはヒト中皮腫の悪性度や血管新生を抑制し、かつ細胞死へと誘導することが判明し、本腫瘍の治療に有用な新しい抗がん剤であることが示唆された。
 |
